Blanchissement de la Grande Barrière de Corail : que se passe-t-il ? Un parallèle vulgarisé et illustré avec nos cultures.
La température joue un rôle central dans la modélisation. Nos modèles de culture intègrent par exemple l’ensemble de la courbe de réponse à la température. C’est une variable centrale dans la prédiction du rendement. Quels sont les effets d’une hausse de la température sur le rendement ?
Un événement majeur de blanchiment (ou « bleaching ») de la Grande Barrière de Corail en Australie est constaté depuis le mois de février 2020. Que se passe-t-il et quels sont les mécanismes biologiques en cause ? Nous allons voir que la température y joue un rôle prépondérant.
Il existe très peu de documentation à ce sujet, mais un effet « blanchiment » a également été observé sur des espèces prairiales dans des conditions climatiques bien particulières. Vous allez voir que l’effet est surprenant ! Bien que les coraux appartiennent au règne animal, ils entretiennent une relation symbiotique avec des algues (qui sont du règne végétal). Nous allons ainsi voir quel parallèle peut être fait entre le blanchiment des coraux et celui des végétaux de grandes cultures.
Le blanchissement de la Barrière de Corail : les faits
Une température de l’océan anormalement chaude
L’Australie a vécu un été incroyablement chaud à l’origine de feux de forêts sans précédent. En conséquence, l’océan a été anormalement chaud depuis fin 2019. La température de l’eau du mois de février 2020 a d’ailleurs été la plus haute jamais mesurée depuis 1900, et de loin (figure 1b) ! Et mars 2020 emboîte le pas… D’ailleurs, dans ce contexte de changement climatique, la température moyenne annuelle de l’océan a augmenté d’à peu près 1,1°C depuis 1900 (figure 1a).
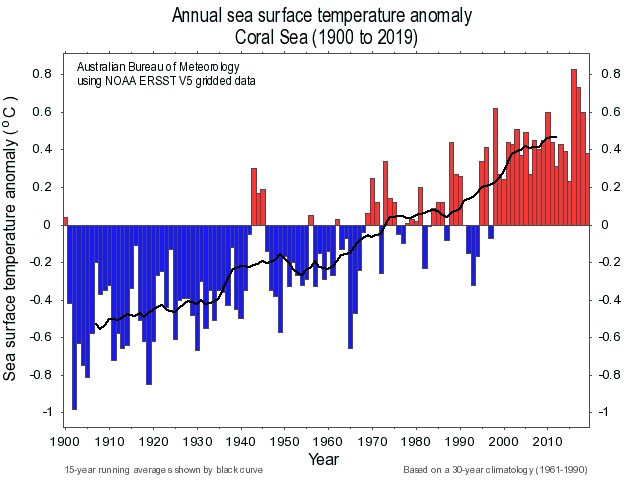
A 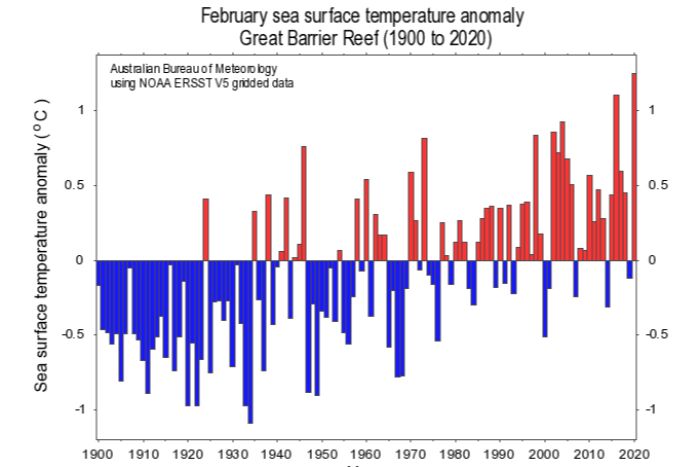
B
Un blanchiment important
Les premières observations remontent aux années 30. Cependant, ce n’est qu’à partir de 1998 que les premiers blanchiments à grande échelle ont été observés. Depuis, quatre nouveaux événements ont été recensés : en 2002, 2016, 2017 puis en 2020 ; les causes respectives de blanchiment ces années-là ne sont pas les mêmes. Les années 1998 et 2016 ont été marquées par de puissants épisodes d’El-Nino qui ont fait monter la température moyenne de la Terre à des niveaux jamais observés. Les années 2019-2020 ne sont quant à elles pas marquées par El-Nino…
Et pourtant ! D’après les observations du Centre of Excellence for Coral Reef Studies et du Great Barrier Reef Marine Park Authority rapportées dans The Conversation par les experts Terry Hughes et Morgan Pratchett, le blanchiment en cours est le plus étendu jamais observé jusqu’à présent : 25.1% de la Barrière a été sévèrement affectée, 35% plus modérément (figures 2 et 3). 2016 reste cependant l’événement de référence quant à la proportion de coraux sévèrement affectés (Claar, Szostek, McDevitt‐Irwin, Schanze, & Baum, 2018).
Lorsque les températures sont modérément élevées, ce processus est réversible. Le corail reprend alors ses couleurs dans les mois suivants. Cependant, lorsque les températures sont hors de la gamme de croissance, le corail, privé de sa source d’énergie, peut mourir.
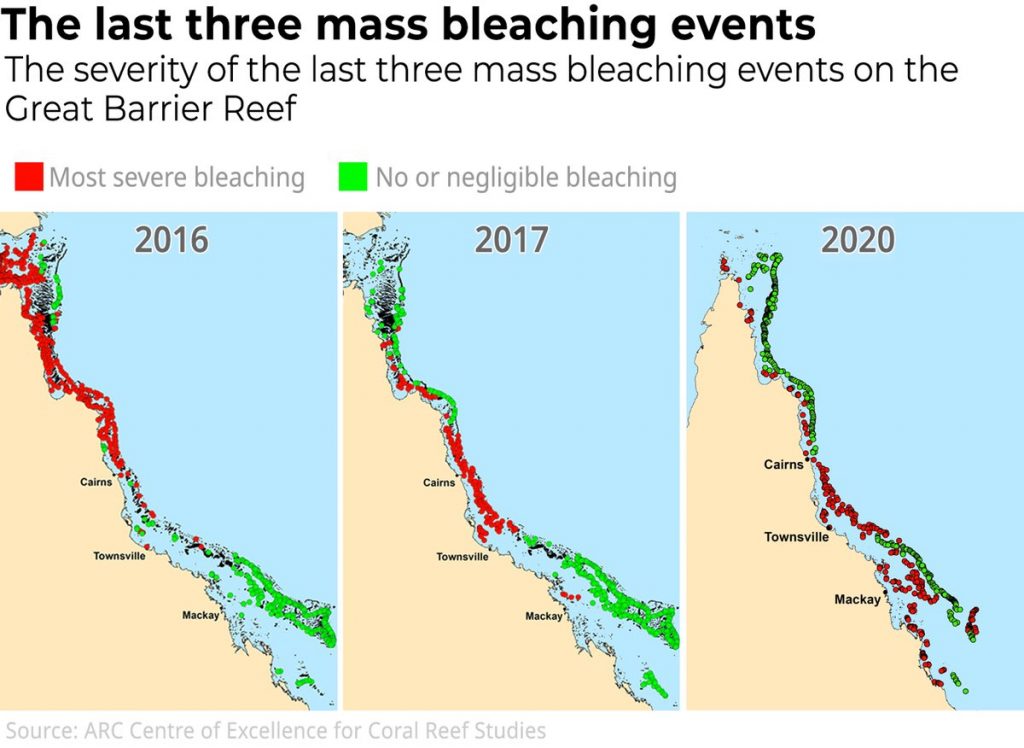

Figure 3a – Photo de Victor Huertas près de Magnetic Island. 
Figure 3b – Photo de Kisten Brown
Ces effets peuvent être également quantifiés par images satellites (sentinel-2) comme le montre la figure 4 datant de 2017.

Comment les végétaux réagissent à la température ?
Une réponse non-linéaire
La température est un facteur de croissance central dans le fonctionnement des végétaux. Tout au long du cycle végétal, elle agit sur l’ensemble de la plante à tous les niveaux d’organisation : sur l’assimilation, la respiration, la transpiration, la fixation azotée, la croissance et le développement (Zaka, 2016).
Pour l’ensemble des processus, la réponse à la température est non-linéaire. Elle est caractérisée par trois températures « cardinales » qui sont propres à chaque espèces (figure 5, exemple du maïs) :
- la température minimale en dessous de laquelle la vitesse de croissance est nulle.
- la température optimale pour laquelle la vitesse maximale.
- la température maximale au-dessus de laquelle la vitesse est nulle.
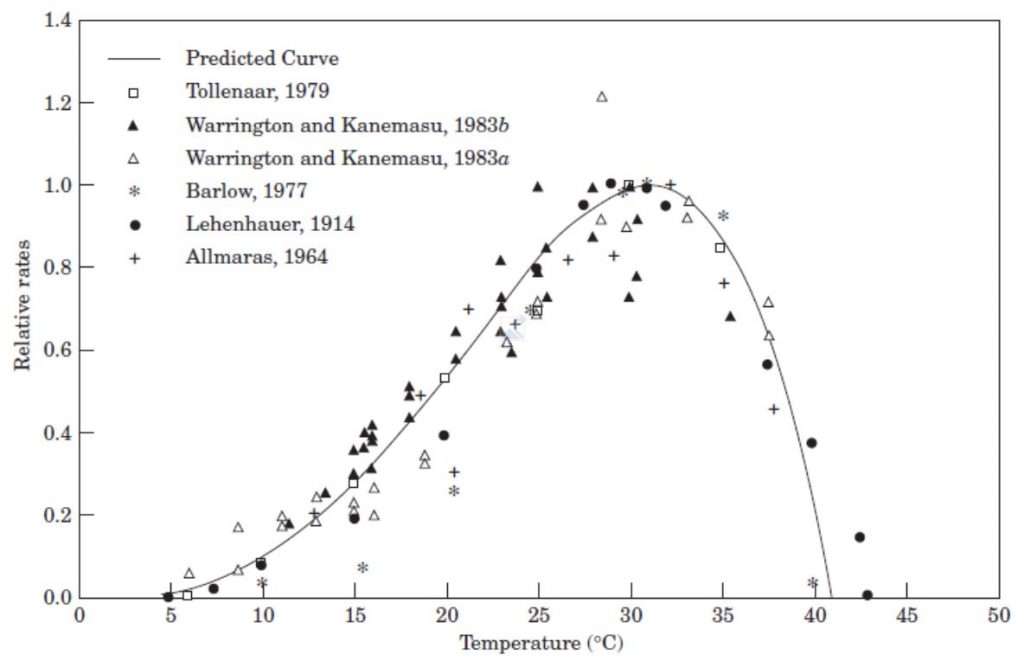
Entre la température minimale et optimale, c’est l’agitation moléculaire qui favorisent l’accélération de la vitesse des réactions chimiques (et par conséquent de la croissance). Au contraire, entre la température optimale et maximale, l’agitation moléculaire favorise la dénaturation des protéines (et par conséquent la baisse de l’efficacité des réactions chimiques). Au de-là, la plante développe des réactions de protection ou de survie. C’est là qu’interviennent les fameuses « Heat Shock Proteins » (i.e. « protéines de choc thermique »).
Les « Heat Shock Proteins » : késako ?
Dans des conditions thermiques stressantes, les plantes peuvent activer des voies de synthèse de protéines dont le rôle est la protection, le maintien et la régulation des fonctions cellulaires. Elles permettent notamment de rétablir la structure des protéines dénaturées pour qu’elles soient à nouveau fonctionnelles. Par exemple, la production de protéines chaperonnes « heat shock proteins HSPs » est induite par les fortes températures (Heckatorn et al., 1998 ; Queitsch et al., 2000). Ces protéines se retrouvent dans pratiquement tous les organismes vivants, des bactéries au humains.
Quels sont les mécanismes physiologiques du blanchiment chez les coraux ?
La réponse à la température de la croissance des coraux est également soumise à une fonction non-linéaire décrite à la figure 5. Lorsque la température de l’eau dépasse la température maximale de développement, les relations symbiotiques animales-végétales s’opérant avec les algues de la familles des Symbiodiniaceae (LaJeunesse et al., 2018) sont affectées et peuvent se rompre : c’est le « bleaching » ou blanchissement (Hughes et al., 2003). Ce blanchiment est dû, sans surprise, à une diminution des pigments de chlorophylle. Il est accompagné d’une chute de l’activité photosynthétique et d’une augmentation de la respiration des algues (Cziesielski et al., 2019). Les échanges d’oxygène et de nutriments des chloroplastes des algues (végétaux) vers les mitochondries des coraux (animaux) sont ainsi stoppés.
Pour le moment, les mécanismes moléculaires en jeu ne sont pas encore totalement compris (Blackstone & Golladay, 2018). Mais les fameuses « Heat Shock Proteins », décrites plus haut, semblent jouer un rôle important (Sharp, Miller, Bythell, & Brown, 1994). Elles sont les marqueurs de la présence d’un stress thermique.
Nos cultures peuvent-elles être concernées ?
Il existe très peu de documentation de « bleaching » ou « blanchiment » de végétaux terrestres en réaction à de hautes températures. Les températures caniculaires sont très majoritairement accompagnées d’un manque d’eau qui empêche les feuilles de se développer (facteur limitant). Il est donc très peu probable d’observer cet effet « bleaching » en conditions naturelles.
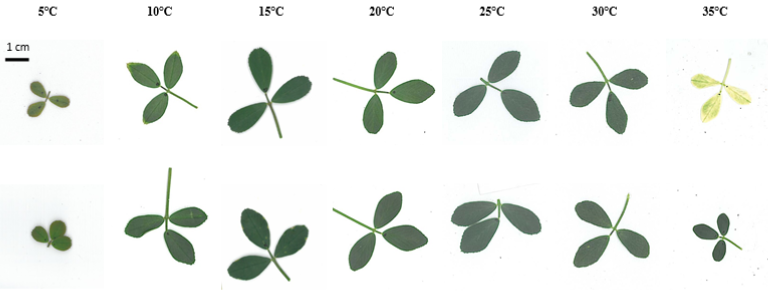
Cependant, en conditions expérimentales (chambres de culture), il a été possible d’observer ce phénomène en France à l’INRAE de Lusignan sur des luzernes et des fétuques (Zaka, 2016; Zaka et al., 2016). Il s’agit du seul cas documenté et photographié que nous avons pu trouver dans la littérature (figures 6 à 8).
La thèse* de Zaka (2016) montre que certains génotypes, en conditions hydriques non limitantes et à des températures fixes supérieures à 35°C, développaient des feuilles viables mais blanches (figures 6 à 8). Tout comme pour le blanchiment des algues, on observe une diminution des pigments de chlorophylle, une chute de l’activité photosynthétique et une augmentation de la respiration de ces feuilles blanches. Il semble donc qu’un processus similaire au blanchiment des coraux ait lieu à savoir un arrêt des échanges d’oxygène et de nutriments des chloroplastes vers les mitochondries. Il ne s’agit que d’une hypothèse.
Lorsque les végétaux sont replacés dans des conditions thermiques plus classiques, les nouvelles feuilles sont de nouveau pigmentées. Cependant, l’effet est irréversible sur les feuilles blanches.

Figure 6a – Effet « bleaching » ou « blanchiment » observé sur la luzerne (Zaka, 2016). 
Figure 6b – Effet « bleaching » ou « blanchiment » observé sur la fétuque (Zaka, 2016).
Et la modélisation dans tout ça ?
Une variable d’entrée majeure
La température est une variable d’entrée majeure pour la modélisation des cultures. Son rôle dans les modèles est double :
- elle prend le rôle d’une variable « pilote » au travers du concept de « températures efficaces » (c’est-à-dire qu’avoir une prédiction de la température donne une indication de la vitesse de développement de la plante dans les jours à venir).
- ou d’une variable de « stress » venant moduler la croissance potentielle de la plante, c’est-à-dire la croissance qu’aurait la plante si toutes les conditions environnementales et nutritionnelles étaient idéales (Brisson et Levrault, 2010 ; Parent et Tardieu, 2014 ; Zaka, 2016).
Lors de son implantation dans les modèles, l’action de la température sur les différents processus est représentée par des formalismes mathématiques généralement simplifiés (Parent et Tardieu, 2014) tout en respectant l’action de la température sur l’ensemble de la gamme de développement.
Une variable essentielle pour la prédiction du rendement
A ce sujet, ITK participe à un séminaire (en ligne, informations et inscriptions) organisé par la Chaire AgroTIC ce mardi 21 avril : « mesurer et estimer le rendement : quels apports et usages des outils numériques ? ».
Dans le modèle « blé » d’itk, nous avons également fait le choix de travailler avec une fonction prenant en compte l’arrêt du développement aux hautes comme aux basses températures.
Cette fonction est au centre de la prédiction de rendement. Par exemple, elle intervient dans :
- l’avancée de la phénologie et donc la détermination des stades post-floraison dont la période de remplissage du grain.
- émission/croissance des feuilles/talles et donc le nombre d’épis et le potentiel de production de matière sèche.
- l’état hydrique et azoté de la plante au travers de l’activité microbiennes du sol (nécessaire à l’utilisation des nutriment par la plante) ou encore la hausse de l’évapotranspiration qui joue sur la demande en eau.
Des effets conséquents sur le rendement
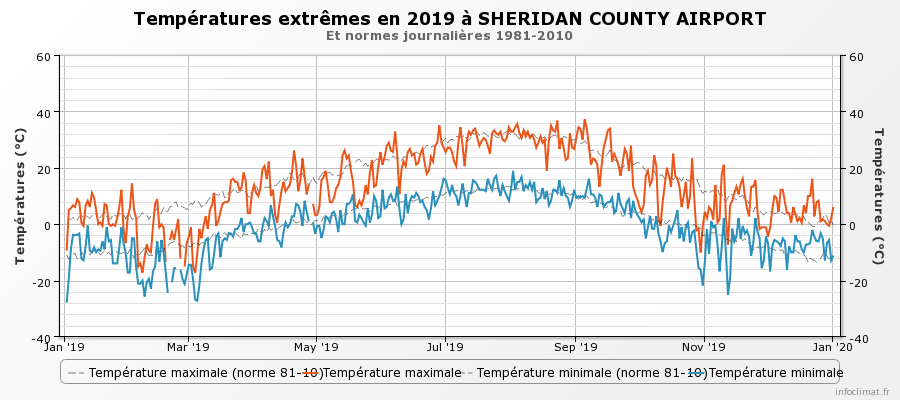
Notre cas d’étude est une parcelle de blé de printemps au sud du Montana, bien fertilisée et irriguée. Le rendement de 2019 est supérieur à la moyenne de l’état. La température moyenne observée en 2019 est de 6,5°C. En juin et juillet, la température moyenne était de 16.4 et 20.8°C respectivement. Les températures mensuelles maximales étaient de 35.0°C le 27 juin et 34.4°C le 7 juillet. La figure 9 donne l’évolution des températures jour par jour à l’aéroport le plus proche.
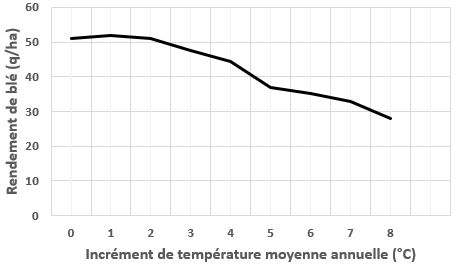
La figure 10 représente l’évolution du rendement en faisant varier la température jusqu’à +8°C par incréments de 1°C, toutes choses égales par ailleurs (irrigations, fertilisations, semis, variété). L’abscisse « 0°C » correspond au climat observé en 2019.
Plusieurs conclusions peuvent être tirées de ce graphique :
- un rendement en légère hausse ou stable jusqu’à +2°C : les températures plus douces au printemps favorisent la croissance végétative. Après la floraison, et durant le remplissage du grain, les températures restent autour de l’optimum (voir les explications de la figure 5).
- un rendement qui chute dès +3°C : les pics de températures estivaux deviennent largement supra-optimaux ce qui a pour conséquence d’accentuer les stress hydriques et thermiques durant le printemps et pendant la phase de remplissage du grain.
Des stratégies d' »évitement »
Avec des températures quotidiennes au dessus de 40°C en juillet, on aurait pu s’attendre à un rendement beaucoup plus bas dès +6°C. La baisse est atténuée par un phénomène d’évitement des fortes chaleurs (Brisson et Levrault, 2010), qui s’explique par l’avancée de l’ensemble des stades phénologiques. Le remplissage du grain ne se fait ainsi plus en juillet mais plutôt en juin.
L’agriculteur peut lui-même adopter des stratégies d’évitement, en choisissant des variétés plus précoces, qui arriveront à maturité plus tôt (au risque d’être un peu moins productives), ou en semant plus tôt (ce qui préserve le potentiel de rendement, mais au prix d’une aggravation du risque de gelée en début de cycle). Les risque et bénéfices de ces stratégies d’évitement peuvent être évalués a priori par la modélisation, en jouant sur les variables d’entrée du modèle. L’adaptation des pratiques d’irrigation, de fertilisation et de protection phytosanitaires, qui devront accompagner ces changements de stratégie, pourront également être calculés par la modélisation.
Conclusion
La température joue un rôle central dans le développement des organismes, avec des effets non-linéaires, aussi bien aux températures basses qu’aux températures élevées. Ces phénomènes sont bien connus et modélisés chez les végétaux, mais aussi chez les animaux hétérothermes (à sang froid), comme les insectes… ou les coraux ! Il n’est donc pas si surprenant d’observer des analogies entre les effets du changement climatique sur les cultures et sur la Grande Barrière de Corail.
Jusqu’à présent, les agriculteurs étaient surtout confrontés aux stress créés par les basses températures. Les accidents climatiques estivaux étaient généralement plutôt dus au stress hydrique qu’à la chaleur en elle-même. Cette situation évolue rapidement, et il devient plus courant d’observer des stress dus à des températures supérieures à l’optimum biologique, même pour des cultures correctement alimentées en eau. Il en résulte des phénomènes agroclimatiques paradoxaux (des retards de croissance dus à la chaleur, et non au froid), ou carrément nouveaux : l’« effet sèche-cheveux » sur vigne, évoqué dans un article précédent d’iTK Labs, ou le blanchiment cité ici (dont nous rappelons toutefois qu’il n’a été observé pour l’instant qu’en laboratoire).
La baisse du rendement due à ces stress thermiques est reproduite dans la modélisation agronomique chez itk. Elle permet notamment d’adapter les pratiques culturales en prévision d’un été chaud, ou même de prévoir certains impacts du changement climatique sur le développement de la plante.
*thèse effectuée à Unité de Recherche Pluridisciplinaire Prairies et Plantes Fourragères par Serge Zaka encadrée par Gaetan Louarn et François Gastal avec le support financier du projet CLIMAGIE et de la Région Poitou-Charentes.
Contact :
Equipe de communication : communication@itk.fr
Equipe d’itk labs : itklabs.agro@itk.fr
Serge Zaka : serge.zaka@itk.fr




Merci pour cet article passionnant qui fait un lien inattendu avec mon terrain de jeu favoris que sont les récifs coralliens ! Bravo pour la richesse des données.